GIST treten in verschiedenen Formen auf: Von kleinen, fast unsichtbaren Tumoren mit einer Größe von 1-2 cm über große, gut isolierte und operable Tumoren bis hin zu blutigen Gewebewucherungen und Metastasen, die wie Perlenketten durch das Bauchgewebe laufen. Alle GIST sind bösartig und können sich im gesamten Körper ausbreiten.
Im Allgemeinen gilt: Frühzeitige Entdeckung sowie professionelle Therapie und Krankheitsmanagement führen meist zu besseren Behandlungsergebnissen und einer verbesserten Prognose.
Es gibt drei verschiedene Erkrankungsstadien:
- Lokal isolierter, operabler Primärtumor (keine Metastasen)
- Inoperabler/metastasierter (fortgeschrittener) GIST
- Progression = Entwicklung einer metastasierten Erkrankung während der Therapie
Die Therapiestrategie sollte durch ein multidisziplinäres Team aus Pathologen, Radiologen, Chirurgen und Onkologen sowie ggf. Gastroenterologen, Nuklearmedizinern, usw. festgelegt werden. Dies hängt vom Erkrankungsstadium, der Lokalisation von Tumor und Metastasen, Genmutationen und dem allgemeinen Gesundheitszustand des Patienten ab.
Lokalisierte GIST
Vor allem bei kleinen GIST ist die vollständige Entfernung die Standardtherapie, sofern keine erhebliche Morbidität erwartet wird. Die sogenannte R0-Resektion (vollständige Entfernung des Tumors) ist ein wichtiger Faktor für die Prognose. Daher sollten operable Tumoren stets in einem chirurgischen Eingriff entfernt werden, sofern eine vollständige Resektion möglich scheint.
Rezidivrisiko und die Frage nach einer adjuvanten Therapie
Es besteht ein erhebliches Rezidivrisiko: bei mehr als der Hälfte aller Patienten kommt es nach der vollständigen Entfernung des Tumors zu einem Rezidiv (= Rückfall) oder der Entstehung von Metastasen. Daher wird eine Risikostratifikation durchgeführt, um festzulegen, ob eine präventive medikamentöse (= adjuvante) Therapie und/oder eine langfristige Nachsorge mit kurzen Zeitabständen angebracht ist.
Risikobewertung: Es gibt eine Reihe von Faktoren, die mit einer erhöhten Wahrscheinlichkeit für ein Rezidiv einher gehen. Die aktuelle Methode zur Bewertung der Rückfallwahrscheinlichkeit ist die Risikoklassifizierung nach dem amerikanischen Pathologen Miettinen aus dem Jahr 2006. Dabei werden Tumorgröße, Zellteilungsrate (= mitotische Teilungsrate/Anzahl der mitotischen Zellen) sowie die Lokalisation des Tumors bewertet.
Die Entscheidung, ob ein Patient eine präventive medikamentöse (= adjuvante) Therapie benötigt, hängt von den Ergebnissen der Risikoklassifikation ab. Patienten mit einem hohen Rückfallrisiko sollten stets eine adjuvante Therapie erhalten, Patienten mit niedrigem Risiko sollten dagegen keine Medikation erhalten. Bei Patienten mit intermediärem Risiko sollte die Entscheidung im Einzelfall getroffen werden.
Das Ziel einer solchen Therapiestrategie besteht darin, das Rückfallrisiko zu senken und den Erfolg des chirurgischen Eingriffs als Primärtherapie zu unterstützen. Ziel ist es, mögliche vorhandene Tumorzellen (auch Mikrometastasen genannt), die noch nicht sichtbar oder nachweisbar sind, zu zerstören.
Derzeit gibt es nur ein Arzneimittel, das für die postoperative, adjuvante Therapie zugelassen ist: Imatinib (Gleevec®/Glivec®).
Neoadjuvante Therapie
Imatinib kann auch in der sogenannten neoadjuvanten Therapie eingesetzt werden. Das bedeutet, dass das Arzneimittel vor dem chirurgischen Eingriff verabreicht wird.
Diese Therapie erfolgt in der Regel:
- … bei großen, scheinbar inoperablen Tumoren
- … wenn sich die Patienten einem großen (umfangreichen, schwerwiegenden) chirurgischen Eingriff mit möglicherweise schweren postoperativen Komplikationen unterziehen müssten
Die neoadjuvante Therapie wird verabreicht, um die Ausgangssituation für den chirurgischen Eingriff zu optimieren. Sie soll dazu dienen, den Tumor operabel zu machen und/oder möglicherweise den Umfang der Operation zu reduzieren. Sie sollte mindestens über einen Zeitraum von 4 bis 6 Monaten verabreicht werden, um die „maximale Reaktion“ zu erhalten, dies ist der ideale Zeitpunkt für den chirurgischen Eingriff. Ein großer Teil der Patienten profitiertvon dieser Therapieform, mit dem Ergebnis, dass der chirurgische Eingriff deutlich weniger umfangreich ausfällt als ursprünglich angenommen.
Metastasierte GIST
Bis zum Jahr 2000 galt der chirurgische Eingriff (= Resektion) als einzige Möglichkeit, fortgeschrittene Krebserkrankungen zu behandeln. Da GIST sowohl gegenüber der herkömmlichen Chemotherapie als auch gegenüber einer Strahlentherapie äußerst widerstandsfähig waren, erwies sich die Therapie als schwierig. Daher lag die durchschnittliche Überlebensdauer bei einer metastasierten Erkrankung bei 12 Monaten.
2002 wurde Imatinib (Gleevec®/Glivec®) für die Behandlung von c-Kit (CD117)–positiven, inoperablen und/oder metastasierten GIST bei Erwachsenen zugelassen. Es handelt sich um die erste „zielgerichtete molekulare Therapie“ für Krebs. Das bedeutet, dass das Arzneimittel nur auf Zellen wirkt, die hochspezifische Ziele exprimieren. Herkömmliche Chemotherapien, die bisher bei Krebs eingesetzt wurden, wirken dagegen auf alle schnell wachsenden Zellen im Körper. Imatinib wirkt bei GIST-Patienten gezielt auf zwei Wachstumsfaktorrezeptoren, KIT und PDGFRA. Bei 90-95 % aller GIST-Patienten können Mutationen in einem dieser beiden Gene nachgewiesen werden. Diese Mutationen sind für die unkontrollierte Zellteilung verantwortlich, die zu Krebs führt. Imatinib wirkt gezielt auf diese Mutationen und unterbindet somit das Tumorwachstum.
Imatinib in einer Dosierung von 400 mg/Tag (bis zu 800 mg/Tag in bestimmten Fällen) ist der Standard in der Primärtherapie, mit der Einnahme sollte direkt nach der bestätigten Diagnose eines metastasierten und/oder inoperablen GIST begonnen werden. Aufgrund der hohen Wirksamkeit und guten Verträglichkeit kann diese Therapie zu einer deutlichen Verlängerung der Lebenserwartung sowie einer Verbesserung der Lebensqualität beitragen.
Ob ein Patient auf eine bestimmte Arzneimitteltherapie anspricht, hängt im Wesentlichen von der Mutation des Primärtumors ab. Deshalb spielt auch hier die Mutationsanalyse eine äußerst wichtige Rolle.
|
Imatinib |
Sunitinib |
|
|
KIT |
||
|
Exon 9 |
800 mg |
Gut |
|
Exon 11 |
Gut |
Schlecht |
|
PDGFR |
||
|
Exon 12 |
Gut |
Keine Daten |
|
Exon 18 (ohne D842V) |
Gut? |
Keine Daten |
|
Exon 18 (D842V) |
Nein |
Nein |
|
Exon 18 (D842Y) |
Gut (Labor) |
Keine Daten |
|
Wildtyp-GIST |
||
|
Schlecht bis befriedigend |
Gut |
Bis heute ist der Stellenwert einer chirurgischen Entfernung von Metastasen bei einer metastasierten Erkrankung und unter einer medikamentösen Therapie unklar: Es existieren keine Daten über mögliche Vor- oder Nachteile eines solchen Eingriffs. Dieser Frage muss in klinischen Studien nachgegangen werden.
Fortschreitende GIST
Krankheitsprogression während der medikamentösen Therapie
Trotz der hohen Wirksamkeit von Imatinib bei GIST, erleidet ein großer Teil der Patienten nach zwei bis drei Jahren einen Krankheitsfortschritt. Dies wird als Imatinib-Resistenz bezeichnet.
Bei einer solchen Progression sind bestimmte Maßnahmen zu ergreifen:
1. Es ist sicherzustellen, dass es sich tatsächlich um eine Progression handelt und dass andere Ursachen ausgeschlossen sind, z. B. Probleme bei der Therapietreue, Wechselwirkungen mit anderen Arzneimitteln, usw.
2. Es ist zu klären, ob die Progression an mehreren Stellen (= systemisch) oder nur an der ursprünglichen Tumorposition (= lokalisiert) auftritt.
Bevor eine systemische Therapie umgestellt wird, sollten weitere Optionen für lokalisierte Behandlungen geprüft werden. Dazu gehören beispielsweise die Radiofrequenzablation (RFA), die laserinduzierte interstitielle Thermotherapie (LTT) und die selektive interne Radiotherapie (SIRT). Da die Therapieoptionen nach wie vor begrenzt sind, ist es entscheidend, sicherzustellen, dass Patienten so lange wie möglich und bei einer angemessenen Lebensqualität von einer Therapie profitieren.
Wird eine Progression bestätigt, so stehen verschiedene Optionen zur Verfügung:
- Erfahrene GIST-Experten können einen individuellen Therapieplan empfehlen, beispielsweise bei einer sehr langsamen Progression. In diesem Fall kann es eine Option sein, zunächst abzuwarten und den Verlauf zu beobachten („Wait & Watch“). Das bedeutet, dass die fortschreitende Erkrankung engmaschig überwacht wird, bis eine Umstellung der Therapie notwendig wird oder sich neue Optionen aus klinischen Studien ergeben.
- Erhöhung der Imatinib-Dosis: Der erste Schritt besteht in der Regel darin, die Imatinib-Dosis auf 800 mg/Tag zu erhöhen. Etwa ein Drittel aller Patienten sprechen dann wieder auf die Therapie an.
- Bei einer Imatinib-Unempfindlichkeit (Resistenz) oder einer Unverträglichkeit (Intoleranz) ist der Multikinasehemmer Sunitinib (Sutent®) eine weitere, effektive Therapie. Im Gegensatz zu Imatinib, das ohne Unterbrechungen verabreicht wird, handelt es sich bei Sunitinib um einen Therapiezyklus (4 Wochen Therapie, gefolgt von einer zweiwöchigen Pause). Es wird in einer Dosierung von 50 mg/Tag verabreicht. In der klinischen Praxis kommt jedoch auch eine Dauertherapie (ohne Pausen) mit einer Dosierung von 37,5 mg/Tag zum Einsatz. GIST-Patienten mit einer Primärmutation in Exon 9 oder ohne Hinweise auf eine Mutation (Wildtyp) können von der Gabe von Sunitinib über einen längeren Zeitraum profitieren.
- Regorafenib/Stivarga® wurde in einigen Ländern für die Behandlung von Patienten mit inoperablen, metastasierenden GIST zugelassen, die nicht länger auf Imatinib und Sunitinib ansprechen. Die Standarddosis für Regorafenib beträgt 160 mg über einen Zeitraum von 3 Wochen, gefolgt von einer einwöchigen Einnahmepause.
- Kommt die Progression nicht zum Stillstand, empfehlen zahlreiche GIST-Experten heute zwei weitere Substanzen (Nilotinib/Tasigna® und Sorafenib/Nexavar®), obgleich diese nicht für die GIST-Therapie zugelassen sind. Diese Anwendung wird als Off-Label ("zulassungsüberschreitende Anwendung“) bezeichnet. Die Substanzen haben sich jedoch in klinischen Studien als wirksam für die Behandlung von GIST erwiesen. Für eine solche Off-Label-Therapie ist eine Vereinbarung (Genehmigung) zwischen dem behandelnden Arzt und der jeweiligen Krankenkasse erforderlich.
- Aufnahme in klinische Studien
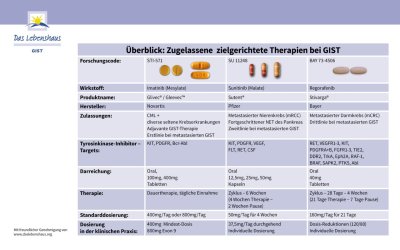
Überblick über derzeit zugelassene zielgerichtete Therapien bei GIST:
Neoadjuvant
The term "neo-adjuvant therapy" (from the Latin adjuvare, meaning to help) refers to therapy that is carried out before the operation (= resection) of a tumor. A neo-adjuvant therapy can generally be chemotherapy, radiation therapy, or treatment using pre-operative targeted therapy. The goal of neo-adjuvant therapy is make the resection of a tumor as easy as possible (e.g. by reducing its size) or to reduce the operation’s scope to a minimum. It’s also referred to "downstaging" a tumour disease.
adjuvant
Adjuvant treatment is a kind of "preventative therapy": After the complete removal of a tumor, adjuvant treatment is given as prophylaxis against recurrences. It aims to treat so called micro metastases that may be present but not yet visible, and therefore lower the risk of a recurrence. Adjuvant therapy is usually recommended for sarcoma patients, whose risk of recurrence – despite a successful operation – remains high.
GIST
Gastrointestinal stromal tumor (GIST) affects the digestive tract or nearby structures within the abdomen. The most common location is the stomach. GI stromal tumor, or GIST cancer, is a sarcoma.