Il GIST si presenta in differenti forme, che vanno dai piccoli, quasi invisibili tumori di 1-2 cm ai grandi tumori, ben isolati, operabili, ad una proliferazione tissutale sanguinante e alle metastasi che passano attraverso il tessuto addominale come perle. Tutti i GIST sono maligni e potenzialmente si possono diffondere in tutto il corpo.
In generale: la scoperta precoce, il trattamento e la gestione professionale di solito portano a risultati migliori e a una migliore prognosi.
Ci sono tre fasi di malattia:
- malattia localizzata, tumore primario operabile (assenza di metastasi)
- GIST inoperabile /metastatizzato (fase avanzata)
- malattia in progressione = sviluppo della malattia metastatizzata durante la terapia
La strategia di trattamento dovrebbe essere discussa in un team multidisciplinare che, ove possibile, includa patologi, radiologi, chirurghi e oncologi medici, così come gastroenterologi, specialisti di medicina nucleare ecc. Ciò dipende dallo stadio della malattia, dalla localizzazione del tumore e sue metastasi, dalle mutazioni geniche e dalle condizioni generali di salute del paziente.
GIST localizzato
GIST localizzato
Specialmente per un piccolo GIST, la completa rimozione è il trattamento standard,
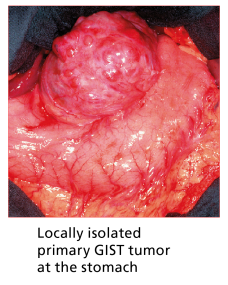 a meno che non ci si aspetti maggiore morbilità. La cosiddetta resezione R0 (rimozione completa del tumore) è un fattore importante per la prognosi. Pertanto, i tumori operabili devono sempre essere rimossi con un intervento chirurgico, se sembra possibile una resezione completa.
a meno che non ci si aspetti maggiore morbilità. La cosiddetta resezione R0 (rimozione completa del tumore) è un fattore importante per la prognosi. Pertanto, i tumori operabili devono sempre essere rimossi con un intervento chirurgico, se sembra possibile una resezione completa.Rischio di recidiva e la questione del trattamento adiuvante
Vi è un rischio significativo di recidiva: oltre la metà di tutti i pazienti sperimentano una ricomparsa della malattia (= recidiva) o uno sviluppo di metastasi dopo la resezione completa. Ecco perché viene fatta una stratificazione del rischio per determinare se sia indicata la terapia farmacologica precauzionale (=adiuvante) e/o un follow-up a lungo termine, a brevi intervalli di tempo.
Stratificazione del rischio: si pensa che una serie di fattori possano portare alla recidiva. L'attuale metodo per valutare la probabilità di recidiva è una classificazione del rischio, creata nel 2006, dal patologo americano Miettinen. Essa prende in considerazione la dimensione del tumore, il tasso di divisione cellulare (= tasso/conta mitotica), ma anche la localizzazione del tumore. La "tabella di Miettinen" si trova nella pagina seguente.
La decisione se un paziente ha bisogno di ricevere un trattamento farmacologico precauzionale (=trattamento adiuvante) dipende dai risultati della classificazione del rischio. I pazienti con un alto rischio di recidiva dovrebbero sempre ricevere un trattamento adiuvante mentre i pazienti con basso rischio non devono ricevere il farmaco in uso adiuvante. Per i pazienti con rischio intermedio, la decisione deve essere presa singolarmente, caso per caso.
L'obiettivo di questa strategia di trattamento è quello di ridurre il rischio di recidiva e mantenere gli effetti della chirurgia come terapia primaria. Ha lo scopo di eliminare eventuali cellule tumorali esistenti non ancora visibili o misurabili, o le micro-metastasi.
Attualmente, solo un farmaco è approvato per il trattamento adiuvante post operatorio: Imatinib (Glivec®).
Trattamento neoadiuvante
Imatinib può essere somministrato anche in uso neoadiuvante. Ciò significa che il farmaco viene somministrato prima dell'intervento chirurgico.
Questo solitamente avviene:
- per grossi tumori, apparentemente inoperabili
- nel caso in cui i pazienti debbano sottoporsi ad una chirurgia estesa, difficile, con possibili gravi complicazioni post-operatorie
Il trattamento neoadiuvante viene applicato al fine di migliorare la situazione iniziale per l'intervento chirurgico: dovrebbe rendere il tumore operabile e/o eventualmente ridurre l’estensione dell'intervento chirurgico. Esso deve essere somministrato per almeno 4 a 6 mesi per ottenere "il massimo della risposta", che rappresenta il momento ottimale per eseguire l’intervento chirurgico. Vale la pena notare che una buona parte di questi pazienti traggono beneficio da questo tipo di trattamento, con il risultato che l'intervento chirurgico è molto meno esteso di quanto inizialmente previsto.
GIST metastatico
GIST metastatico
Fino al 2000, l'unico modo per trattare anche i tumori avanzati era la chirurgia (= resezione chirurgica). Poichè il GIST si è rivelato molto resistente sia alla chemioterapia tradizionale che alla radioterapia, era molto difficile da trattare: il tempo medio di sopravvivenza con malattia metastatica era di 12 mesi.
Nel 2002, Imatinib (Gleevec®/Glivec®) è stato approvato per
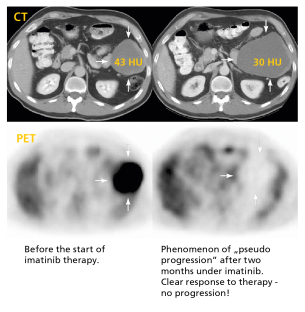 il trattamento dei GIST positivi a c-kit (CD117) non operabili e/o metastatici, negli adulti. E’ questa la prima "terapia molecolare mirata " in commercio per il cancro. Ciò significa che il farmaco colpisce solo le cellule che esprimono target altamente specifici, al contrario delle chemioterapie convenzionali contro il cancro che colpiscono tutte le cellule dell’organismo, a crescita rapida. I bersagli di imatinib nei pazienti con GIST sono due recettori dei fattori di crescita denominati KIT e PDGFRA. Nel 90-95% di tutti i pazienti GIST, possono essere rilevate mutazioni in uno di questi geni. Queste mutazioni sono responsabili della divisione cellulare incontrollata che porta al cancro. Imatinib colpisce specificamente queste mutazioni e quindi ferma la crescita del tumore.
il trattamento dei GIST positivi a c-kit (CD117) non operabili e/o metastatici, negli adulti. E’ questa la prima "terapia molecolare mirata " in commercio per il cancro. Ciò significa che il farmaco colpisce solo le cellule che esprimono target altamente specifici, al contrario delle chemioterapie convenzionali contro il cancro che colpiscono tutte le cellule dell’organismo, a crescita rapida. I bersagli di imatinib nei pazienti con GIST sono due recettori dei fattori di crescita denominati KIT e PDGFRA. Nel 90-95% di tutti i pazienti GIST, possono essere rilevate mutazioni in uno di questi geni. Queste mutazioni sono responsabili della divisione cellulare incontrollata che porta al cancro. Imatinib colpisce specificamente queste mutazioni e quindi ferma la crescita del tumore.Imatinib nel dosaggio di 400 mg /die (800 mg /die in casi specifici) è la terapia standard di prima linea e deve essere iniziata subito dopo la diagnosi confermata di GIST metastatico e/o inoperabile. A causa della grande efficacia e della buona tollerabilità, può contribuire ad un significativo aumento delle aspettative e della qualità della vita.
Se un paziente è in grado di rispondere o meno ad una determinata terapia farmacologica dipende molto dalla mutazione del tumore primario. Ancora una volta, quindi, l'analisi mutazionale è estremamente importante.
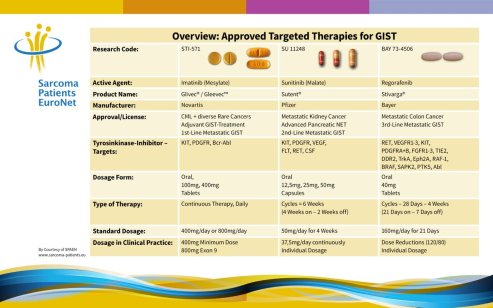
| Imatinib | Sunitinib | |
| KIT | ||
| Esone 9 | 800 mg | Buono |
| Exon 11 | Buono | Non efficace |
| PDGFR | ||
| Exon 12 | Buono | Nessun dato |
| Exon 18 (senza mutazione D842V) | Buono? | Nessun dato |
| Exon 18 (D842V) | No | No |
| Exon 18 (D842Y) | Buono (Lab) | Nessun dato |
| Wild type GIST | ||
| Non soddisfacente | Buono |
Fino ad oggi, non è ancora chiaro il beneficio della chirurgia delle metastasi in una situazione metastatica e sotto terapia farmacologica: non ci sono dati su possibili vantaggi o svantaggi dell’intervento chirurgico. Questo deve essere valutato in studi clinici.
Progressione della malattia durante la terapia farmacologica
Progressione della malattia durante la terapia farmacologica
Nonostante l'elevata efficacia di imatinib nei GIST, la progressione della malattia dopo due o tre anni, purtroppo, è rilevata in una percentuale considerevole di pazienti. Viene chiamata resistenza a imatinib.
Quando questo accade, devono essere prese alcune misure:
- Verificare che sia effettivamente progressione di malattia ed escludere altri motivi quali ad esempio problemi di aderenza alla terapia, interazione con altri farmaci, ecc.
- Chiarire, se si sta verificando in diverse localizzazioni (=progressione sistemica) o solo nel sito originario del tumore (= progressione localizzata.)
Prima di passare ad altre terapie, dovrebbero essere valutate altre possibilità di trattamenti localizzati. Tali trattamenti includono la radiofrequenza (RFA), Termoterapia Interstiziale indotta da Laser (LITT) e Radioterapia interna selettiva (SIRT). Poiché le opzioni terapeutiche sono ancora limitate, è essenziale assicurarsi che i pazienti traggono beneficio da qualsiasi terapia il più a lungo possibile con una qualità di vita accettabile.
Se la progressione di malattia è confermata, ci sono diverse opzioni:
- Esperti con comprovata esperienza nei GIST possono suggerire un piano di trattamento individualizzato, per esempio se la progressione è molto lenta. In questo caso, l’approccio di "osservare e aspettare" può essere un'opzione. Questo significa monitorare attentamente la progressione di malattia fino a quando è necessaria una modifica della terapia, o emergano nuove opzioni terapeutiche dagli studi clinici.
- Aumento della dose di Imatinib: di solito il primo passo dopo la conferma di progressione è quello di aumentare la dose di Imatinib a 800 mg / die. Circa un terzo di tutti i pazienti dimostrano di rispondere di nuovo al farmaco.
- In caso di resistenza (o intolleranza) ad imatinib, l'inibitore multichinasico Sunitinib (Sutent®) offre un’altra, efficace possibilità terapeutica. A differenza di Imatinib – che si somministra come terapia continua - Sunitinib è somministrato con un ciclo di terapia di 6 settimane (4 settimane di terapia, seguite da 2 settimane di interruzione) somministrato alla dose di 50 mg /die. Nella pratica clinica, tuttavia, è anche usata una terapia continua (senza interruzioni) alla dose di 37,5 mg /die. I pazienti con GIST con una mutazione primaria nell'esone 9, o senza mutazioni (GIST wild type) possono trarre beneficio da Sunitinib per un periodo di tempo più lungo.
- Regorafenib / Stivarga® è stato approvato in molti paesi per il trattamento di pazienti con GIST non resecabile metastatico che non rispondono più a imatinib e sunitinib. La dose standard per Stivarga è di 160 mg per 3 settimane seguito da 1 settimana di interruzione.
- Se la progressione continua, molti esperti in GIST raccomandano attualmente altri due farmaci (Nilotinib / Tasigna® e Sorafenib / Nexavar®), anche se non sono approvati per il trattamento dei GIST. Questo tipo di utilizzo è definito "uso off-label". Tuttavia, questi farmaci negli studi clinici hanno dimostrato di essere efficaci nel trattamento dei GIST. La somministrazione di queste terapie off-label richiede un accordo (consenso) tra il medico curante e l'assicurazione sanitaria o il servizio sanitario.
- Inclusione negli studi clinici.
GIST
Gastrointestinal stromal tumor (GIST) affects the digestive tract or nearby structures within the abdomen. The most common location is the stomach. GI stromal tumor, or GIST cancer, is a sarcoma.