GISTの形態は多様であり、1~2 cmのほとんど気づかれない小さな腫瘍から、限局性で手術可能な大きな腫瘍、組織で増殖し出血を来す腫瘍、真珠のように腹部の組織内に散らばり転移する腫瘍などがあります。GISTはすべて悪性であり、全身に広がる可能性があります。
一般的に、早期の発見および専門医による治療と管理によって、比較的良好な転帰が得られ、予後が改善されます。
GISTには3つの病期があります:
- 限局性で手術可能な原発腫瘍(転移なし)
- 手術不可能な、または転移を伴う(進行)GIST
- 増悪、すなわち治療中の転移
治療方針については、病理医、放射線科医、外科医、化学療法を専門とする腫瘍医、消化器内科医、核医学専門家などの集学的チームで適宜、話し合われるべきです。治療方針は、病期、腫瘍や転移のある部位、遺伝子変異、患者の全身状態に基づいて決定されます。
限局性GIST
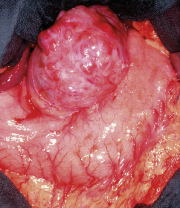 小さなGISTの場合は特に、手術による重篤な病態が予測されない限り、完全切除が標準的な治療となります。いわゆる「R0切除(腫瘍を完全に取り除くこと)」は、予後に影響を及ぼす重要な要素となります。したがって、完全切除が可能と判断された腫瘍は必ず、手術で取り除くべきです。
小さなGISTの場合は特に、手術による重篤な病態が予測されない限り、完全切除が標準的な治療となります。いわゆる「R0切除(腫瘍を完全に取り除くこと)」は、予後に影響を及ぼす重要な要素となります。したがって、完全切除が可能と判断された腫瘍は必ず、手術で取り除くべきです。
再発のリスクと術後補助療法
GISTは再発のリスクが非常に高く、半数以上の患者が、完全切除の後に再発または転移を経験しています。それゆえに、リスク層別化が行われ、予防的薬物療法(術後補助療法)や短い間隔での長期的フォローアップが必要であるか否かが判断されるのです。
リスク層別化: 再発には多くの要素が関わっていると考えられています。再発しやすさを評価するために現在用いられている基準は、米国の病理学者Miettinenが2006年に開発したリスク分類です。Miettinen分類では腫瘍の大きさ、細胞分裂率(核分裂率または核分裂数)、そして腫瘍の位置が考慮されます。
薬による予防的治療(術後補助療法)が必要か否かは、リスク分類の結果に基づいて判断されます。再発リスクの高い患者は術後補助療法を必ず受けるべきであり、リスクの低い患者は受けるべきではありません。中間リスクの患者は個別の判断が必要となります。
術後補助療法の目的は、再発リスクを低減し、主要な治療法である手術の効果をサポートすることです。すなわち、まだ目に見えなかったり、測定不能であったりしても存在する可能性のある腫瘍、あるいは微小転移を除去するために術後補助療法が実施されるのです。
現在、術後補助療法薬として唯一承認されている薬はイマチニブ(商品名:グリベック)です。
術前補助療法
イマチニブは「術前補助療法(ネオアジュバント療法)」としても用いられることがあります。手術の前に行われる薬物療法のことです。
一般的に、以下の場合に行われます:
- 腫瘍が大きく、手術が不可能と判断される。
- 重篤な術後合併症のリスクを伴う、広範囲の難しい手術が必要と判断される。
術前補助療法の目的は、手術前の病態を改善することであり、腫瘍を手術可能な状態にしたり、切除範囲を最小限に抑えられるようにしたりします。手術に最適なタイミングとなる「最大奏効率」達成に至るまでには、少なくとも4~6カ月間、実施する必要があります。切除範囲が当初の予測よりもはるかに狭まるという術前補助療法の効果が、かなりの割合の患者で得られている事実は、特筆に値します。
転移性GIST
 2000年以前は、進行がんであっても手術(切除)が唯一の治療手段でした。従来の化学療法や放射線療法はいずれも、GISTに対して極めて奏効しにくいと判明したことから、GISTは治療が困難とされていました。当時、転移のある患者の平均生存期間は12カ月でした。
2000年以前は、進行がんであっても手術(切除)が唯一の治療手段でした。従来の化学療法や放射線療法はいずれも、GISTに対して極めて奏効しにくいと判明したことから、GISTは治療が困難とされていました。当時、転移のある患者の平均生存期間は12カ月でした。
しかし2002年、ついにイマチニブ(グリベック)が、切除不能または転移性の、あるいはその両方のc-Kit (CD117)陽性成人GISTに対する治療薬として承認されました。この薬は最初に市販された、がんに対する「分子標的治療薬」です。従来のがん化学療法薬が増殖速度の速い細胞すべてに作用するのに対し、分子標的治療薬は、特異性の高い標的を発現している細胞にだけ作用します。GISTでは、イマチニブの標的はKITおよびPDGFRAという2つの増殖因子受容体(遺伝子)です。GISTの患者全体の90~95%でKIT遺伝子またはPDGFRA遺伝子のどちらかで変異が検出されます。これらの変異は、がんに至らしめる制御不能な細胞分裂の原因です。イマチニブは、これらの変異を標的として作用し、腫瘍の増殖を阻止するのです。
標準的な一次治療では、イマチニブが1日400 mg(特別なケースでは800 mg)の用量で投与されます。転移性GISTあるいは切除不能GISTの診断が確定され次第、投与開始となります。イマチニブは有効性と忍容性に優れているため、大幅な余命延長とQOL(生活の質)の向上に寄与します。
ある特定の薬物療法が奏効する見込みがあるか否かは、原発腫瘍の変異によって大きく左右されます。したがって、変異解析は極めて重要であることを再度、心に留めおいてください。
|
イマチニブ |
スニチニブ |
|
|
KIT |
||
|
エクソン 9 |
800 mg |
良好 |
|
エクソン 11 |
良好 |
不良 |
|
PDGFR |
||
|
エクソン12 |
良好 |
データなし |
|
エクソン 18 (D842V以外) |
良好? |
データなし |
|
エクソン 18 (D842V) |
なし |
なし |
|
エクソン 18 (D842Y) |
良好 (臨床検査値) |
データなし |
|
野生型GIST |
||
|
不良~ 満足 |
良好 |
転移があり、薬物療法を継続している状態で、転移巣を切除することの意義は、その切除による利益あるいは不利益に関するデータがないため、現在のところ不明です。したがって、これについては臨床試験で評価する必要があります。
薬物療法継続中の病勢増悪
GISTに対するイマチニブの有効性は高いとはいえ、残念ながら、投与開始後2、3年の時点でかなりの割合の患者で病勢増悪が認められます。これをイマチニブ抵抗性といいます。
イマチニブ抵抗性が生じたら、講じるべき一定の対処策があります。
真に病勢増悪であるのかを確認し、イマチニブを指示通りに服用したかというコンプライアンスの問題や別の薬との相互作用など、イマチニブ抵抗性以外の原因が考えられないかを検討します。
病勢増悪が複数の部位で起きているのか(全身性)、あるいは原発巣のみで起きているのか(限局性)を明らかにします。
治療法を切り替える前に、ラジオ波焼灼療法(RFA)、レーザー誘起間質温熱療法(LITT)、選択的内部照射療法(SIRT)などの局所治療も選択肢として検討されるべきです。とはいえ、選択肢は限られているため、QOLを許容範囲内に保ちつつ、できる限り長い期間効果が得られる治療法を選ぶことが重要です。
増悪が確認された場合、いくつかの選択肢があります。
- 経験豊富なGISTの専門医であれば、個々の患者に適した治療計画を提案することが出来ます。たとえば、増悪のスピードが非常に遅い場合は「(注意深い)経過観察」も1つの選択肢となるでしょう。「(注意深い)経過観察」とは治療法の変更が必要となるまで、あるいは臨床試験の結果、新たな選択肢が世に出るまで、病勢増悪を注意深く監視することを意味します。
- イマチニブの用量増量:増悪が確定すると、一般的には最初にイマチニブの用量が1日800 mg(800 mg/日)に増量されます。これにより約3分の1の患者で再び効果が現れます。
- イマチニブ抵抗性が生じたかイマチニブの副作用に耐えられない場合は、マルチキナーゼ阻害薬であるスニチニブ(商品名:スーテント)が次の有効な治療手段となります。イマチニブが連続的に投与されるのに対し、スニチニブの場合は50 mg/日を4週間投与した後2週間休薬という1サイクル6週間のサイクルが繰り返されます。しかし、実際の臨床では37.5 mg/日を連続投与(休薬期間なし)する場合もあります。エクソン9に一次変異が認められるGISTか、変異が認められない(野生型)GISTの患者では、スニチニブの効果がより長期間得られる可能性があります。
- 国によっては、イマチニブおよびスニチニブが効かなくなった切除不能な転移性GISTに対する治療薬としてレゴラフェニブ(商品名:スチバーガ)が承認されています。スチバーガの標準用法では、160 mg/日を3週間投与した後1週間の休薬というサイクルが繰り返されます。
- 増悪が続く場合、現在、GIST専門医の多くは、ニロチニブ(商品名:タシグナ)またはソラフェニブ(商品名:ネクサバール)を勧めます。これら2剤は欧州ではGISTの治療薬としては承認されていないため「適応外使用」となりますが、臨床試験ではGISTに対し有効であることが示されています。「適応外使用」に際しては、主治医と当該医療保険との合意(同意)が必要です。
- 臨床試験への参加。
GIST
Gastrointestinal stromal tumor (GIST) affects the digestive tract or nearby structures within the abdomen. The most common location is the stomach. GI stromal tumor, or GIST cancer, is a sarcoma.





